Il y a cent ans, le physicien Wolfgang Pauli publiait son principe d’exclusion, un concept fondamental qui allait révolutionner notre compréhension de la chimie de base, révéler de nouveaux éléments sur la structure de l’atome, et même expliquer le comportement des étoiles à neutrons. Ce concept est si important que les physiciens s’en servent encore aujourd’hui pour classer les particules subatomiques : celles qui obéissent au principe d’exclusion sont appelées fermions, et celles qui n’y obéissent pas, bosons.
Sans le principe d’exclusion, on ne saurait pas expliquer pourquoi les molécules stables existent, ni comment les électrons se répartissent dans un atome. Mais en quoi consiste-t-il exactement, et pourquoi est-il si fondamental ?
Le principe d’exclusion de Pauli, expliqué
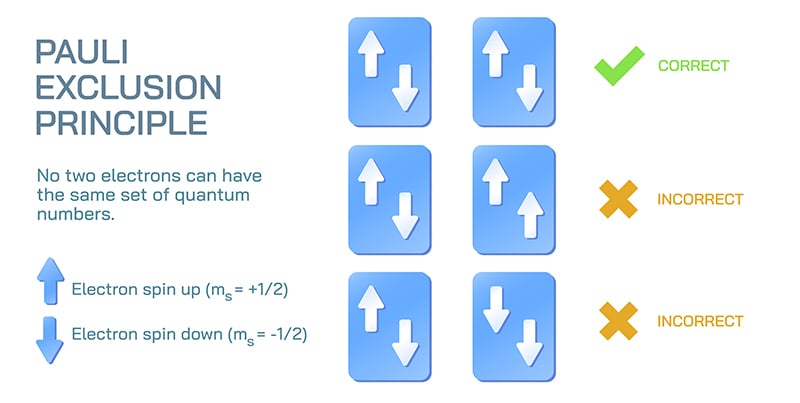
Au fond, le principe d’exclusion est simple : deux fermions identiques dans un même système ne peuvent pas occuper le même état quantique. Dans un atome standard, par exemple, ce principe dicte que chaque électron doit occuper un état quantique distinct. Et qu’est-ce qu’un état quantique ? « L’état, c’est l’ensemble des paramètres nécessaires pour décrire une particule, » explique Leonardo A. Lessa, doctorant en matière quantique à l’Institut Périmètre. « Dans le cadre du Modèle standard, c’est une combinaison de la position de la particule dans l’espace réel, et de certains degrés de liberté internes. »
Dans le cas d’un seul électron dans un atome, la combinaison de son emplacement dans l’espace réel et de ses degrés de liberté internes se résume en quatre nombres appelés nombres quantiques. Ces nombres décrivent essentiellement la distance de la particule par rapport au noyau, la forme et l’énergie de son orbite, ainsi qu’une valeur de spin. Le nombre quantique de spin est particulièrement important dans la théorie de Pauli, car il l’a introduit précisément pour expliquer son principe. Mais comme le souligne Lessa, ce n’est pas ce que l’on croit.
« Le spin, c’est un peu comme si la particule était une balle qui tourne sur elle-même. Mais ce n’est pas une balle, et elle ne tourne pas, » dit-il, en citant une blague bien connue parmi les chercheurs en mécanique quantique. « Elle s’appelle comme ça parce qu’elle agit comme un spin. Elle donne physiquement à la particule un moment angulaire. Parce que lorsqu’un objet tourne, il a un moment angulaire autour d’un axe. Le spin est une sorte de moment angulaire intrinsèque que la particule peut avoir. »
Et voilà le principe d’exclusion : lorsque l’on décrit des fermions identiques dans un système, aucun d’eux ne peut avoir exactement les mêmes valeurs pour les quatre nombres quantiques.
Mais comment Pauli a-t-il découvert ce concept fondamental — et du même coup créé un tout nouveau nombre quantique ? C’est une histoire qui l’a vu interagir avec plusieurs des plus grands physiciens de son époque.
Le chemin de Pauli vers l’exclusion
Pauli, véritable prodige, est né en 1900 — la même année où Max Planck publiait son idée d’énergie quantifiée, qui allait donner naissance à la mécanique quantique. Fasciné très jeune par ces avancées, Pauli lisait Einstein au primaire et s’est orienté vers la physique théorique à l’université.
Il est aussi resté célèbre pour deux raisons. La première : ses critiques impitoyables des idées qu’il jugeait insuffisamment développées. Il aurait un jour qualifié un article de si médiocre qu’il « n’était même pas faux », une expression encore utilisée aujourd’hui pour désigner les théories pseudoscientifiques. La seconde : l’effet Pauli, cette tendance mystérieuse des appareils expérimentaux à tomber en panne lorsqu’il entrait dans un laboratoire. Même si ce phénomène n’a jamais été prouvé scientifiquement, Pauli, dit-on, s’amusait beaucoup chaque fois qu’un appareil cessait soudainement de fonctionner en sa présence.
Pauli était au départ sceptique à l’égard de la théorie quantique, qu’il a décrite comme un « choc que chaque physicien… a connu » dans le discours qu’il a prononcé en recevant le prix Nobel de physique. Pendant ses études à l’Université de Munich, il a été initié à la structure de l’atome par Arnold Sommerfeld, son directeur de doctorat et figure majeure de la mécanique quantique. À l’époque, les physiciens tentaient de concilier la mécanique classique avec la nouvelle approche quantique pour mieux comprendre la structure de la matière. On savait déjà que la série de nombres issue de 2n² (2, 8, 18, 32, par exemple) jouait un rôle fondamental en chimie, mais sans en comprendre la raison.
Un tournant survient en 1922, lorsque Pauli rencontre Niels Bohr, le physicien qui avait développé un modèle atomique tenant compte de la mécanique quantique. C’est à ce moment-là que Pauli est exposé à l’idée des couches électroniques : le concept selon lequel les électrons entourent le noyau selon des orbites disposées en couches de plus en plus éloignées du centre. Chaque couche possède un niveau d’énergie différent selon sa distance, et chaque élément chimique a un nombre précis de couches en fonction notamment du nombre d’électrons. D’ailleurs, c’est ce nombre de couches qui détermine l’organisation en rangées du tableau périodique des éléments.
Les couches électroniques semblaient logiques, mais Pauli — comme d’autres physiciens — ne comprenait pas pourquoi tous les électrons ne se retrouvaient pas simplement dans la couche la plus proche du noyau, là où l’énergie est la plus faible. Après tout, la plupart des systèmes physiques tendent vers un état de plus basse énergie… alors pourquoi pas les particules subatomiques ?
Il manquait un élément, quelque chose qui permettrait de mieux décrire l’état quantique de chaque particule. Dans ses recherches, Pauli arrive à ce qu’il nomme une « propriété à deux valeurs, impossible à décrire classiquement ». Ce concept deviendra le spin — le quatrième nombre quantique. Cette fameuse « balle qui tourne sans tourner ». L’aspect « à deux valeurs » vient du fait qu’une particule peut avoir un spin orienté vers le haut (spin up) ou vers le bas (spin down).
Grâce à ce quatrième nombre quantique, Pauli pouvait enfin expliquer pourquoi les électrons occupent différentes couches autour d’un noyau : parce qu’ils ne peuvent pas tous avoir exactement les mêmes valeurs pour les quatre nombres quantiques. Les électrons d’une même couche doivent donc différer légèrement. Ce principe explique aussi pourquoi chaque couche, en s’éloignant du noyau, peut contenir au maximum 2, 8, 18, 32 électrons, et ainsi de suite.
Le principe de Pauli dans le monde réel (et dans l’univers)
Aujourd’hui, le principe d’exclusion nous permet de comprendre non seulement les particules microscopiques comme les électrons, mais aussi des objets gigantesques comme les étoiles à neutrons. En fait, c’est ce principe qui empêche une étoile à neutrons de s’effondrer en trou noir.
« Les étoiles à neutrons sont des objets célestes qui se forment dans des conditions extrêmes bien précises de l’univers, » explique Lessa. « Ce sont des corps extrêmement compacts composés presque exclusivement de neutrons. »
En physique classique, les étoiles maintiennent leur forme grâce à un équilibre entre deux forces : la gravité, qui pousse vers l’intérieur, et les réactions nucléaires, qui exercent une pression vers l’extérieur. Lorsque la gravité devient plus forte que la pression produite par les réactions nucléaires, l’étoile commence à s’effondrer sur elle-même.
Les étoiles à neutrons se forment lorsque des étoiles supermassives s’effondrent — un processus qui peut aussi mener à la formation de trous noirs. Dans une étoile à neutrons, la gravité devient si intense que les électrons et les protons des atomes subissent une réaction qui les transforme en neutrons.
Une fois ces neutrons formés, ils peuvent se compacter beaucoup plus que les atomes initiaux, car ils ne portent pas de charge électrique qui les repousserait entre eux. Mais ils exercent alors une nouvelle force, appelée « pression de dégénérescence des neutrons ». Combinée à la force nucléaire répulsive entre les neutrons, cette pression empêche l’étoile de s’effondrer davantage — grâce au principe d’exclusion, qui interdit à deux fermions, comme les neutrons, d’occuper exactement le même état quantique. Les neutrons restent donc suffisamment espacés pour éviter de franchir le seuil qui ferait de l’étoile un trou noir… sauf si de la matière s’ajoute, ou si l’étoile était simplement trop massive dès le départ.
Grâce au principe d’exclusion, les physiciens de l’Institut Périmètre — et d’ailleurs — continuent de faire des découvertes à la fois sur les plus petites et les plus grandes structures de l’univers. Qu’il s’agisse de comprendre les réactions chimiques ou la formation des trous noirs, le principe de Pauli est une pierre angulaire sur laquelle repose la recherche fondamentale de demain.
« C’est magnifique, » dit Lessa, « de pouvoir atteindre une compréhension fondée sur des principes fondamentaux, pour expliquer pourquoi les choses sont comme elles sont. Même si ces règles de la mécanique quantique sont, en un sens, très fragiles… elles conspirent à faire en sorte que tout fonctionne. »
À propos de l’IP
L'Institut Périmètre est le plus grand centre de recherche en physique théorique au monde. Fondé en 1999, cet institut indépendant vise à favoriser les percées dans la compréhension fondamentale de notre univers, des plus infimes particules au cosmos tout entier. Les recherches effectuées à l’Institut Périmètre reposent sur l'idée que la science fondamentale fait progresser le savoir humain et catalyse l'innovation, et que la physique théorique d'aujourd'hui est la technologie de demain. Situé dans la région de Waterloo, cet établissement sans but lucratif met de l'avant un partenariat public-privé unique en son genre avec entre autres les gouvernements de l'Ontario et du Canada. Il facilite la recherche de pointe, forme la prochaine génération de pionniers de la science et communique le pouvoir de la physique grâce à des programmes primés d'éducation et de vulgarisation.